A. Klarifikasi Ikatan

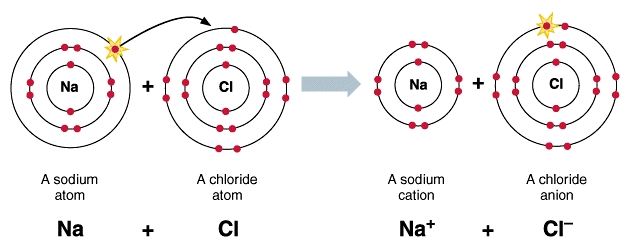
Ikatan yang terbentuk sebgai akibat adanya gaya tari menarik antara ion positif (kation) dan ion negatif (anion).
2. Ikatan Kovalen
Ikatan yang terjadi antara nonlogam dengan nonlogam dengan cara pemakian bersama pasangan elektron. Adakalnya dua atom menggunakan lebih dari satu pasang elektron. Apabila yang digunakan bersama dua pasang atau tiga pasang elektron disebut sebai ikatam kovalen rangkap dua dan rangkap tiga. Jumlah elektron valensi yang digunakan untuk berikatan tergantung pada kebutuhan tiap atom untuk mencapai konfigurasi elektron.


3. Ikatan Logam
Ikatan tariik menarik muatan positif dan negatif yang bergerak bebas didalam logam. Ikatan logam berpengaruh terhadap titik leleh suatu logam. Semakin banyak elektron valensi maka ikatan logam semakin kuat. Hal ini menyebabkan titik leleh logam semakin tinggi.

4. Ikatan Hidrogen
Gaya tarik menarik yang terjadi antara atom H dengan atom yang sangat elektronegatif yaitu F, O, N. Molekul yang dapat membentuk ikatan hidrogen antar molekul mempunyai titik diidh yang tinggi.

B. Faktor Geometri
1. Jari-jari atom dan ionik

Jari-jari atom adalah jarak dari inti atom ke orbital elektron terluar. Terdapat bebarapa jenis jari-jari atom taitu jari-jari atom logam, kovalen dan ionik. Jari-jari atom logam yaitu separuh jarak antar inti atom, sedangkan jari-jari atim kovalen yaitu separuh jarak atom logam antara 2 atom yang sama terikat secara bersama oleh ikatan kovalen, dan yang terakhir jari-jari ataim ionik yaitu jarak antara 2 inti yang terhubung oleh ikatan elektrostatik antara kation dan anion.
2. Entalpi Kisi

Siklus Born-Habera adalah suatu pendekatan yang digunakan untuk menganalisi energi reaksi. Untuk memutuskan ion-ion bebas dari kisi membutuhkan energi yang besar. Nilai dari energi kisi bergantung pada kekuatan ikatan ion. Kekuatan ion berkaitan erat dengan ukuran dan muatan ion.
3. Tetapan Modelung
Energi potensial Coulomb total antar ion dalam senyawa ionik yang
terdiri atas ion A dan B adalah penjumlahan energi potensial Coulomb
interaksi ion individual, Vab. Karena lokasi ion-ion dalam kisi
kristal ditentukan oleh tipe struktur, potensial Coulomb total antar
ion dihitung dengan menentukan jarak antar ion d. A adalah tetapan
Madelung yang khas untuk tiap struktur krista
4. Struktur Kristal Logam
a) Body Centered Cubic (BCC)

5) Kristal Ionik
Struktur dasar kristal ion adalah ion yang lebih besar (biasanya anion) membentuk susunan terjejal dan ion yang lebih kecil (biasanya kation) masuk kedalam lubang oktahedral atau tetrahedral di antara anion. Kristal anion diklasifikasikan kedalam beberapa tipe struktur berdasarkan jenis kation dan anion yang terlibat dan jari-jari ionnya.
Anion membentuk koordinasi polihedra disekeliling kation. Jari-jari rX adalah separuh sisi polihedral dan jarak kation di pusat polihedral ke sudut polihedral merupakan jumlah jari-jari kation dan anion rX + rM Jarak dari pusat ke sudut polihedral : √3rX , √2rX, ½ √6Rx
C. Faktor Elektronik
Ikatan dan struktur senyawa ditentukan oleh sifat elektronik seperti kekuatan atom-atom penyusun dalam menarik dan menolak elektron. Orbital molekul yang diisi elektron valensi, susunan grometrisnya dipenaruhi oleh interaksi elektronik antar elektron non ikatan.
1) Muatan Inti Efektif
Muatan positif inti sedikit banyak dilawan oleh elektron negatif bagian dalam (di bawah elektron valensi), muatan inti yang dirasakan oleh elektron valensi suatu atom dengan nomor atom Z akan lebih kecil dari muatan inti Ze. Penurunan ini disebut Konstanta Perisai ( σ ) dan muatan inti netto disebut dengan Muatan Inti Efektif (Zeff)
Persaman : Zeff = Z – σ
2) Energi Ionisasi
Energi Ionisasi adalah energi minimum yang diperlukan untuk mengeluarkan elektron dari atom dalam fase gas (g). energi ionisasi yang kecil biasanya diperlukan oleh unsur yang berada di dalam satu golongan yang sama. Namun beda halnya dengan unsur yang ada dalam periode yang sama, maka akan diperlukan energi ionisasi yang semakin besar. Jadi, secara singkat energi ionisasi dapat diartikan sebagai energi yang diperlukan untuk melepaskan sebuah elektron dari suatu atom netral.
Grafik Energi Ionisasi (Ei)
3) Afinitas Elektron
Afinitas Elektron merupakan negatif entalpi penangkapan elektron oleh atom dalam fasa gas. Sehingga didefinisikan Afinitas Elektron Pertama adalah energi yang dilepaskan ketika 1 mol atom gas mendapatkan satu elektron untuk membentuk 1 mol ion gas.
4) Ke-Elektronegatifan
a) L. PAULING
Pauling pertama kali mengajukan konsep elektronegativitas pada tahun 1932 sebagai penjelasan dari fenomena lebih kuatnya ikatan kovalen antar dua atom berbeda (A–B) dari yang diperkirakan dengan mengambil kekuatan rata-rata ikatan A–A dan B–B. Menurut teori ikatan valensi, "stabilisasi tambahan" dari ikatan heteronuklir ini disebabkan oleh kontribusi bentuk kanonis ion kepada ikatan.
Perbedaan elektronegativitas antara dua atom A dan B dapat dihitung dengan:
dengan Energi disosiasi (Ed) ikatan A–B, A–A dan B–B diekspresikan dalam elektronvolt. Faktor (eV)−½ disisipkan untuk menghasilkan nilai yang tidak berdimensi. Dengan metode ini, perbedaan elektronegativitas antara hidrogen dan bromin adalah 0,73 (energi disosiasi: H–Br 3,79 eV; H–H 4,52 eV; Br–Br 2,00 eV)
b) Elektronegativitas Mulliken
mengajukan bahwa aritmetika dari energi ionisasi pertama dan afinitas elektron haruslah adalah sebuah perhitungan dari kecenderungan sebuah atom menarik elektron-elektron. Karena definisi ini tidak bergantung pada skala relatif sembarang, ia juga disebut sebagai elektronegativitas relatif, dengan satuan kilojoule per mol atau elektronvolt.
Namun biasanya kita menggunakan transformasi linear untuk melakukan transformasi nilai absolut tersebut menjadi nilai yang lebih mirip dengan nilai Pauling. Untuk energi inonisasi dan afinitas elektron dalam elektronvolt,
c) Elektronegativitas Allred–Rochow
Allred dan Rochow beranggapat bahwa elektronegativitas haruslah berhubungan dengan muatan sebuah elektron pada "permukaan" sebuah atom , semakin tinggi muatan per satuan luas permukaan atom, semakin besar kecenderungan atom tersebut untuk menarik elektron-elektron. Muatan inti efektif, Z* yang terdapat pada elektron valensi dapat diperkirakan dengan menggunakan kaidah Slater. Sedangkan luas permukaan atom pada sebuah molekul dapat dihitung dengan asumsi luas ini proposional dengan kuadrat jari-jari kovalen (rcov). rcov memiliki satuan ångström,
Orbital molekul adalah orbital-orbital dari dua atom yang saling tumpang tindih agar dapat menghasilkan ikatan kovalen.
Syarat pembentukan orbital molekul ikatan:
(1) Cuping orbital atom penyusunnya cocok untuk tumpang tindih.
(2) Tanda positif atau negatif cuping yang bertumpang tindih sama.
(3) Tingkat energi orbital-orbital atomnya dekat.
Kesimpulan :
Sumber :













